Реферат: Искусственные минералы
Министерство образования Республики Беларусь Белорусский
Государственный Университет Транспорта
Кафедра’ Строительные конструкции, основания и фундаменты ‘
Научная конференция на тему:
‘Искусственные минералы’
Выполнили
Студенты гр. ПК-21
Власов Ю.А.
Махвиеня С.О.
Искусственные минералы.
Искусственное получение минералов представляет известный интерес. С одной
стороны, это позволяет исследовать процессы минералообразования, с другой –
даёт возможность получать нужные для практики минеральные вещества, что
широко используется в технологии строительных материалов.
Искусственным путем (методом синтеза) можно получать минералы, которые
встречаются в природных условиях (алмаз, корунд, кварц и др.), и минералы,
которые в природных условиях самостоятельно не встречаются (алит, белит и
др.), а входят в состав различных технических продуктов, таких как цементы,
огнеупоры и т.д.
Искусственно полученные естественные минералы путем синтеза из исходных веществ
выгодно отличаются от своих аналогов, образованных в природных условиях, так
как в них отсутствуют химические и механические примеси. В настоящие время в
промышленных целях получен ряд минералов, которые редко встречаются в природе,
но обладают ценными свойствами (флюорит, корунд и др.). В 1961 в СССР
синтезированы искусственные алмазы, прочность которых была в 40% выше
естественных. В таблице 1 приведены некоторые минералы полученные
искусственно.
Некоторые естественные минералы, полученные искусственно
| Минералы | Формула | Минералы | Формула | | Сфалерит | ZnS | Самородная | | | Корунд . . | А1203 | сера .... | S | | Галенит . . | PbS | Ангидрит . . | CaSO4 | | Барит .... | BaSO4 | Энстатит . . . | mr (Si206) | | Магнетит | FeFe2O4 | Малахит . . . | CuCO∙Cu(OH)2 | | Оливин . . | (Fe, Mg)2(Si04) | Шпинель . . | A12 Mg04 | | Полевые шпаты | — | Кварц .... | SiO2 | | Самородная | | Галит .... | NaCl | | медь . . . | Cu | Асбест . . . | — | | Карбонаты . . | — | Слюды .... | — . | | Алмаз . . . | С | Пирофиллит . | — |
Методы синтеза естественных минералов можно разделить на две группы:
1) синтез проводимый в условиях нормального давления.
2) синтез осуществляемый при повышенных давлениях.
В настоящие время получение искусственных минералов сводится к следующим
процессам :
1) кристаллизация расплава;
2) реакции, в которых участвуют газовые компоненты;
3) получение минералов в присутствие водных растворов;
4) получение минералов путем реакции в твердой среде.
Методы синтеза минералов требуют специальной аппаратуры, длительны по времени
и весьма трудоёмки. В целом задача синтеза минералов еще далеко не решена.
Однако в настоящие время многим исследователям стран СНГ удалось получить
целый ряд ценных минералов, которые перестали быть достоянием лабораторий и
освоились промышленностью.
Ниже дается краткое описание искусственных минералов, которые встречаются в
технических продуктах (цементы, огнеупоры и т.д.), и некоторых высокопрочных
кристаллов. Многие из этих минералов входят в состав различных технических
продуктов. В связи с этим их описание даётся по группам минералов, выделенных
по химическому составу (табл.2).
Искусственные минералы технических продуктов и высокопрочные кристаллы(таб.2)
| Группа | Минералы | Химическая формула | | Силикаты кальция | А ЛИТ Белит Волластоипт Псевдоволластонит Ранкинит | 3CaO∙SiO2 2CaO∙SiO β-CaO-SiO2 α –CaO∙SiO2 3CaO-2Si02 | | Алюминаты кальция | Трехкальциевый алюминат Пятикальциевый трех-алюминат Однокальциевый алюминат Однокальциевый двухалюминат | ЗСаО∙А12О3 5CaO∙3Al2O3 CaO∙Al203 CaO∙2Al2O3 | | Алюмосиликат кальция | Геленит | 2CaO∙Al2O∙SiO2 | | Алюмосиликат | Муллит | 3Al2O3-SiO2 | | Силикаты кальция и магния | Окерманит Монтигеллит | 2CaO-MgO-2SiO2 CaO-MgO-2SiO2 | | Алюмоферрит кальция | Целит | От CaO-Fe2O3 до 8CaO-3 Al2O3-Fe2O3 | | Ферриты кальция | Однокальциевый феррит Двухкалышевый феррит | CaO-Fe2O3 2CaO-Fe2O3 |
| Группа | Минералы | Химическая формула | Окислы и гидроокислы Окислы и гидроксилы | Известь (свободная окис Известь (свободная окись кальция) Портлаидит (гидрат окиси кальция) Периклаз (окись магния) Кремнезем Тридимит Кристобалит | СаО СаО Са (ОН)2 MgO SiO2 Si02 Si02 | | Гипс и продукты его обезвоживания | Гипс α-полугидрат β-полугидрат Ангидрит | CaS04.2H20 CaSO4-0,5H20 CaSO4-0,5H2O CaSO4 | | Прочие соединения кальция | Ольдгамит Перовскит | CaS CaO∙TiO2 | | Высокопрочные кристаллы | Карбиды вольфрама Карбиды молибдена Нитрид ниобия Карбид бора Карбид кремния | WC и W2C Mo2C и МоС Nb3N5 B4C SiC |
Искусственные минералы технических продуктов.
Силикаты кальция.
Алит (трехкальцевый силикат) 3CaO∙SiO2
представляет собой бесцветные мелкие кристаллы в виде гексагональных табличек
или призм (иногда игловидных) с неясно выраженной спайностью по одному
направлению (рис. 1). Сингония тригональная. Кристаллы нередко обнаруживают
зональную структуру, особенно хорошо видную при изучении препаратов в
отраженном свете. Погасание прямое или под небольшим углом. Однослойный,
показатели преломления Ng=1,772, Np=1,718, двойное лучеприломление
малое: Ng- Np=0.004. Оптический знак кристалла отрицателен.
Твердость алита по шкале Мооса колеблется между 5 и 6, удельный вес 3,2.
Является главным минералом портландцементного клинкера, входит также в
доломитовые огнеупоры. Легко может гидратироваться и разлагаться соляной
кислотой, способен твердеть под водой.
Белит (двухкальциевый силикат) 2СаО • 5SiO2 в трех
видах: α-, β- и γ-формы, причем по оптическим данным
αиβ между собою весьма сходны, а переход в γ-форму
сопровождается резким изменением свойств α- и β-фор-мы образуют
правильные округлые зерна, часто призматического облика, со спайностью по
призме (рис. 1). Для белита во многих случаях характерна сложная двойниковая
структура и темноокрашенные включения, имеющие правильную ориентировку. В
шлифах эти формы имеют желтоватую окраску. За счет растворенных Fе2О
3 и Сг2О3 зерна приобретают коричневый или зеленый
цвет.
β-форма белита под микроскопом наблюдается в виде трех разновидностей: 1)
зерен с двумя или тремя системами взаимнопересекающихся штрихов, каждая из
которых состоит из параллельных линий, 2) форм с одной системой двойниковых
пластинок; 3) несдвойникованных зерен.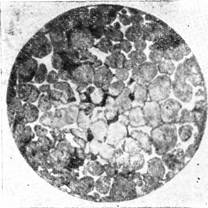 Показатели преомления α- и β-форм: Ng=1,735, Nр=1,717, Ng —
Nр = 0,018, оптический знак положительный. Удельный вес 2,974.
Показатели преомления α- и β-форм: Ng=1,735, Nр=1,717, Ng —
Nр = 0,018, оптический знак положительный. Удельный вес 2,974.
| Рис. 1 Кристаллы белита в клинкере (210Х) |
γ-2СаО∙ЗSiO2 (фелит) имеет призматический облик со
спайностью по призме; погасание прямое; показатели преломления: Ng =
1,654, Nр= 1,642, Ng — Nр=0,012. Это низкотемпературная форма,
возникающая из β-формы при 675° С, имеет плотность примерно на 10% меньше
плотности α- и β -белита, поэтому такое превращение сопровождается
разрушением вещества до состояния тонкой пыли. Появление фелита в вяжущих
породах и огнеупорах нежелательно, так как по способности к гидратации и
твердению эта форма не активна и в ряде случаев (доломитовые огнеупоры)
приводит к разрушению. Вода на γ-форму не действует, она легко
разлагается кислотами.
Белит в значительных количествах присутствует в портландцементном клинкере, в
шлаках, доломитовых и магнезиально-доломитовых огнеупорах. Портландцемент с
высоким содержанием белита отличается замедленным твердением, но зато стоек к
разрушающему действию агрессивных вод.
 Волластонит
β-СаО∙5SiO2 и псевдоволластонит α-СаО-5SiO
2— однокальциевые силикаты. Волластонит — природный минерал, образуется
также при расстекловании некоторых технических стекол. Форма кристаллов
игольчатая, брусковидная и волокнистая со спайностью, параллельной удлинению.
Система моноклинная. Ng = 1,631, Nр = 1,616, Ng — Nр =
0,015. Оптический знак отрицательный. Погасание параллельно удлинению.
Рис. 2. Псевдоволластонит в стекле (74 X) Удельный вес 2,915. В воде не
разлагается, в кислотах легко растворяется.
Псевдоволластонит имеет форму округлых зерен или шестиугольных бесцветных
табличек с ясно различимой спайностью и иногда с полисинтетическими
двойниками (рис. 2). Удельный вес 2,912. Ng=1,654, Nр = 1,610, Ng— Nр =
0,044, оптический знак положительный. Цвета интерференции яркие (красные,
зеленые, желтые тона). Оба минерала характерны для шлаков.
Ранкинит ЗСаО • 2SiO2 (трехкальциевый дисиликат) встречается в
основных и кислых доменных шлаках в виде округлых неправильных по очертаниям
зерен, по-видимому, ромбической (?) сингонии. В отдельных случаях ранкинит
дает крупные порфировые выделения. Показатели преломления: Ng=1,650, Nр=
1,641, двупреломле-ние слабое: Ng —Nр = 0,009, оптический знак
положительный.
Алюминаты кальция
В эту группу входят несколько минералов: трехкальциевый алюминат,
пятикальциевый трехалюми-нат, моноалюминат кальция и однокальциевый двуалю-
минат.
Трехкальциевый алюминат ЗСаО • А12О3
кристаллизуется в кубической сингонии и образует изометрические бесцветные
мелкие зерна с прямоугольными или гексагональными очертаниями и с
несовершенной спайностью. Это соединение может находиться также в аморфном
состоянии.
Кристаллы трехкальциевого алюмината изотропны, N=1,710, твердость 6, удельный
вес 3,04. Может растворять в себе до 2,5% Ре2О3,
замещающих А1203, и тогда N=1,715. Способен легко
гидратироваться и твердеть с выделением большого количества тепла. Растворяется
в кислотах. Входит в состав цементного клинкера. В шлифах наиболее легко
устанавливается методом окрашивания.
Пятикальциевый трехалюминат 5СаО • ЗА12Оз кристаллизуется в
кубической системе в виде округлых, реже треугольных зерен без спайности.
Бесцветный, в составе шлаков окрашен в интенсивно зеленый цвет. Оптически
изотропен, N=1,608. Мол-сет растворять в себе до 2% Ре2О3
, замещающих А1203, тогда N=1,613. Твердость 5, удельный
вес 2,69—2,71.
Неустойчивая форма пятикальциевого трехалюмината обычно представлена
игольчатыми или таблитчатыми индивидами ромбической сингонии, которые
нередко собраны в сферолитовые радиально-лучистые стяжения. Кристаллы в
прозрачных шлифах имеют бледно-зеленую окраску с ясно выраженным плеохроизмом
от оливково-серых до голубовато-зеленых тонов. Ng=1,692, Nр = 1,687, Ng-Np =
0,005. Погасание прямое.
Пятикальциевый трехалюминат входит в состав глиноземистых доменных шлаков,
клинкеров глиноземистого и портлендского цемента, причем в последнем в виде
самостоятельных выделений не встречается.
Однокальциевый алюминат СаО • А12О3 образует
таблитчатые прямоугольные очертания, бесцветные кристаллы со спайностью в
одном направлении. Нередко наблюдаются сложные и псевдогексагональные тройнико
вые срастания. Погасание табличек прямое; Ng=1,663, Np=1,643, Ng — Np =
0,020; оптический знак отрицательный. Может растворять в себе до 15% СаО • А1
2О3, при этом Ng = 1,720, а Np=1,70. Удельный вес 2,981.
Является главной минералогической частью глиноземистого цемента и входит в
состав доменного шлака.
Однокальциевый двухалюминат СаО • 2А12Оз образует
моноклинные сильно вытянутые игольчатые или призматические кристаллы иногда
длиной в несколько миллиметров. Бесцветен. Имеет большой угол погасания (до
31°), благодаря чему легко распознается. Показатели преломления: Ng=1,654, Np =
1,617, двуиреломление высокое— 0,035. Оптически положителен. Присутствует в
клинкере глиноземистого цемента.
Алюмосиликат кальция
Геленит 2СаО • А12Оз • 51О2 кристаллизуется в
квадратной сингонии и дает прозрачные бесцветные таблички или призмы ,с ясно
различимой спайностью, расположенной поперек его удлиненных
кристаллов. Иногда образует кре -
стообразные скелетные формы роста. Показатели
преломления: Ng=1,669, Nр = 1,658. Двупреломление умеренное:Ng—
Nр= 0,011. Цвета интерференции беловато-желтые.Оптический знак
отрицательный. Одноосный.
Разлагается в солянойкислоте. В глиноземистых
цементах геленит размещается между кристаллами однокальциевого алюмината
или прорастает их. По свойствам относится к инертной части цемента.
Типичный минерал доменныхшлаков (рис. 3). Волластонит
β-СаО∙5SiO2 и псевдоволластонит α-СаО-5SiO
2— однокальциевые силикаты. Волластонит — природный минерал, образуется
также при расстекловании некоторых технических стекол. Форма кристаллов
игольчатая, брусковидная и волокнистая со спайностью, параллельной удлинению.
Система моноклинная. Ng = 1,631, Nр = 1,616, Ng — Nр =
0,015. Оптический знак отрицательный. Погасание параллельно удлинению.
Рис. 2. Псевдоволластонит в стекле (74 X) Удельный вес 2,915. В воде не
разлагается, в кислотах легко растворяется.
Псевдоволластонит имеет форму округлых зерен или шестиугольных бесцветных
табличек с ясно различимой спайностью и иногда с полисинтетическими
двойниками (рис. 2). Удельный вес 2,912. Ng=1,654, Nр = 1,610, Ng— Nр =
0,044, оптический знак положительный. Цвета интерференции яркие (красные,
зеленые, желтые тона). Оба минерала характерны для шлаков.
Ранкинит ЗСаО • 2SiO2 (трехкальциевый дисиликат) встречается в
основных и кислых доменных шлаках в виде округлых неправильных по очертаниям
зерен, по-видимому, ромбической (?) сингонии. В отдельных случаях ранкинит
дает крупные порфировые выделения. Показатели преломления: Ng=1,650, Nр=
1,641, двупреломле-ние слабое: Ng —Nр = 0,009, оптический знак
положительный.
Алюминаты кальция
В эту группу входят несколько минералов: трехкальциевый алюминат,
пятикальциевый трехалюми-нат, моноалюминат кальция и однокальциевый двуалю-
минат.
Трехкальциевый алюминат ЗСаО • А12О3
кристаллизуется в кубической сингонии и образует изометрические бесцветные
мелкие зерна с прямоугольными или гексагональными очертаниями и с
несовершенной спайностью. Это соединение может находиться также в аморфном
состоянии.
Кристаллы трехкальциевого алюмината изотропны, N=1,710, твердость 6, удельный
вес 3,04. Может растворять в себе до 2,5% Ре2О3,
замещающих А1203, и тогда N=1,715. Способен легко
гидратироваться и твердеть с выделением большого количества тепла. Растворяется
в кислотах. Входит в состав цементного клинкера. В шлифах наиболее легко
устанавливается методом окрашивания.
Пятикальциевый трехалюминат 5СаО • ЗА12Оз кристаллизуется в
кубической системе в виде округлых, реже треугольных зерен без спайности.
Бесцветный, в составе шлаков окрашен в интенсивно зеленый цвет. Оптически
изотропен, N=1,608. Мол-сет растворять в себе до 2% Ре2О3
, замещающих А1203, тогда N=1,613. Твердость 5, удельный
вес 2,69—2,71.
Неустойчивая форма пятикальциевого трехалюмината обычно представлена
игольчатыми или таблитчатыми индивидами ромбической сингонии, которые
нередко собраны в сферолитовые радиально-лучистые стяжения. Кристаллы в
прозрачных шлифах имеют бледно-зеленую окраску с ясно выраженным плеохроизмом
от оливково-серых до голубовато-зеленых тонов. Ng=1,692, Nр = 1,687, Ng-Np =
0,005. Погасание прямое.
Пятикальциевый трехалюминат входит в состав глиноземистых доменных шлаков,
клинкеров глиноземистого и портлендского цемента, причем в последнем в виде
самостоятельных выделений не встречается.
Однокальциевый алюминат СаО • А12О3 образует
таблитчатые прямоугольные очертания, бесцветные кристаллы со спайностью в
одном направлении. Нередко наблюдаются сложные и псевдогексагональные тройнико
вые срастания. Погасание табличек прямое; Ng=1,663, Np=1,643, Ng — Np =
0,020; оптический знак отрицательный. Может растворять в себе до 15% СаО • А1
2О3, при этом Ng = 1,720, а Np=1,70. Удельный вес 2,981.
Является главной минералогической частью глиноземистого цемента и входит в
состав доменного шлака.
Однокальциевый двухалюминат СаО • 2А12Оз образует
моноклинные сильно вытянутые игольчатые или призматические кристаллы иногда
длиной в несколько миллиметров. Бесцветен. Имеет большой угол погасания (до
31°), благодаря чему легко распознается. Показатели преломления: Ng=1,654, Np =
1,617, двуиреломление высокое— 0,035. Оптически положителен. Присутствует в
клинкере глиноземистого цемента.
Алюмосиликат кальция
Геленит 2СаО • А12Оз • 51О2 кристаллизуется в
квадратной сингонии и дает прозрачные бесцветные таблички или призмы ,с ясно
различимой спайностью, расположенной поперек его удлиненных
кристаллов. Иногда образует кре -
стообразные скелетные формы роста. Показатели
преломления: Ng=1,669, Nр = 1,658. Двупреломление умеренное:Ng—
Nр= 0,011. Цвета интерференции беловато-желтые.Оптический знак
отрицательный. Одноосный.
Разлагается в солянойкислоте. В глиноземистых
цементах геленит размещается между кристаллами однокальциевого алюмината
или прорастает их. По свойствам относится к инертной части цемента.
Типичный минерал доменныхшлаков (рис. 3).
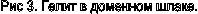 Алюмосиликат
Муллит ЗА12О3 • 5Ю2 образует игловидные,
призматические или волокнистые кристаллы с ясно различимой совершенной
спайностью. Сингония ромбическая. В чистом виде бесцветен, но от примесей
Ре2Оз и 5Ю2 часто получает розовую или синеватую окраску.
Алюмосиликат
Муллит ЗА12О3 • 5Ю2 образует игловидные,
призматические или волокнистые кристаллы с ясно различимой совершенной
спайностью. Сингония ромбическая. В чистом виде бесцветен, но от примесей
Ре2Оз и 5Ю2 часто получает розовую или синеватую окраску.
 Эти примеси ведут к повышению
светопреломления до Ng=1,682, Np=1,661 и Ng — Np=0,021, в то время как у чистых
муллитовых кристаллов Ng=1,654, Np = 1,642, а Ng — Np = 0,012.
Оптически положительный. Эти примеси ведут к повышению
светопреломления до Ng=1,682, Np=1,661 и Ng — Np=0,021, в то время как у чистых
муллитовых кристаллов Ng=1,654, Np = 1,642, а Ng — Np = 0,012.
Оптически положительный.
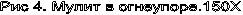 Минерал может давать сростки и скопления (рис. 4). Примеси Fе2О3
и SiO2 вызывают появление плеохроизма в желтоватых и голубоватых
тонах. Удельный вес муллита 3,03. Размер кристаллов муллита разнообразен: от 2
до 5 мк в шамоте до 10 мм по длине в муллитовых изделиях.
Входит также в состав фарфора.
Силикаты кальция и магния
Окерманит 2СаО •МgО-2SiO2 встречается в природе и образуется
искусственно в виде бесцветных квадратных коротких призм или табличек с
показателями преломления: Ng=1,638, Nр=1,631. Двупреломление слабое:
Ng — Np = 0,007. Оптический знак положительный. Одноосный. Окерманит во всех
отношениях смешивается с геленитом, образуя серию геленитокерманитов
(мелилиты), оптические свойства которых варьируют вместе с составом. Форма
таких кристаллов сходна с геленитом. Их сингония тетрагональная. Удельный вес
3,18. Входят в состав магнезиальных цементов, огнеупоров, шлаков.
Монтичеллит СаО • МgО • 2SiO2 кристаллизуется в
ромбической системе и дает в природе и в технических продуктах бесцветные
призматические зерна со слабой неясной спайностью. Сингония ромбическая.
Удельный вес 3,2. Оптические свойства изучены недостаточно. Показатели
преломления при содержании его в виде 10%-ного твердого раствора
2MgO∙5SiO2 имеют следующие величины: Ng= 1,655—1,651,
Np=1,638—11,640, Ng—Nр = = 0,015, оптический знак положительный.
Встречается в различных шлаках.
Алюмоферрит кальция
Целит (алюмоферрит кальция) представляет собой кристаллы, состав которых
может варьировать от 8СаО • ЗА12О3 • Fе2О
3 до СаО • Fе2О3. Кристаллы целита в
портландцементном клинкере заполняют промежутки между алитом и белитом, иногда
создавая тончайшие прорастания с другими второстепенными минералами. Они имеют
призматическую или округлую форму, сингония ромбическая, цвет от светло-бурого
до темно-бурого. В шлифах ясно выражен плеохроизм от светло-желтых до
темно-бурых оттенков, угол погасания весьма мал. В отраженном свете целит
имеет большую отражательную способность, в силу чего кажется светлоокрашенным.
По данным Н. А. Торопова (1950), в клинкере с повышенным содержанием окиси
железа состав целита приближается к 2СаО ∙ Fе2О3 в
нормальных клинкерах — к 4СаО ∙ А12О3 ∙ Ре
2О3 и 8СаО ∙ ЗА12О3 ∙Ре2
О3.
Показатели преломления для 4СаО∙А12О3∙Fе2
О3 (разновидности, называемой браунмиллеритом): Ng =
2,08, Np=1,98, Ng — Np = 0,10. От содержания в нем 1—2% МgО (периклаза)
светопреломление несколько снижается, а клинкер приобретает характерную
зелено-серую окраску. Удельный вес 3,77. Присутствие браунмиллерита снижает
экзотермический эффект твердения портландцемента. Встречается также в шлаках.
Ферриты кальция
В эту группу входят два минерала: однокаль-циевый феррит СаО∙Fе2
О3 и двухкальциевый феррит 2СаО∙Fе2О3.
Оба они играют роль минерализаторов в различных огнеупорах и некоторых видах
портландцемента.
Однокальциевый феррит СаО∙Fе2О3 представляет
собой длинные игольчатые кристаллы, слабо прозрачные под микроскопом. Сингония
квадратная или гексагональная. Окраска черная, а в порошке интенсивно красная.
Показатели преломления: Ng = 2,465, Np = 2,345, двупре-ломление высокое: Ng
— Np = 0,120. Феррит в твердом состоянии может растворять в себе до 10%
СаО∙А12О3 и тогда показатели преломления снижаются:
Ng = 2,25, Np = 2,13, а двупреломление Ng — Np = 0,12. Растворяется
в кислотах. Встречается в составе клинкера глиноземистого цемента.
Двухкальциевый феррит 2СаО∙Fе2О3
кристаллизуется в виде черных кристаллов, которые в шлифах имеют
желтовато-бурую окраску. Спайность отсутствует Ng = 2,29,
Np = 2,20, Ng — Np = 0,090. Оптически положительный. Растворяется в соляной
кислоте.
Двухкальциевый феррит при гидратации твердения не дает. Образуется в
доломитовых огнеупорах, в портландцементе и шлаках. В магнезитовых
огнеупорных массах применяется как ускоритель спекания периклаза.
Окислы и гидроокислы
Известь СаО (свободная окись кальция) представляет собой бесцветные
кристаллы кубической сингонии. Форма зерен округлая. Встречаются кубики или
кучные скопления с ясно выраженной спайностью по трем взаимно перпендикулярным
направлениям. Кристаллы оптически изотропны. Их показатель преломления N=1,836.
В шлифах отличается грубым рельефом. СаО присутствует в клинкере
портландцемента (до 10%) обычно в виде мелких зернышек, которые иногда
наблюдаются внутри кристаллов ЗСаО∙А12О3, а также
в мартеновских шлаках и т. д. В отраженном свете СаО определяется методом
травления поверхности шлифов (микрохимические реакции).
Портландит (гидрат окиси кальция) Са(ОН)2. Образует
бесцветные шестиугольные кристаллы гексагональной сингонии с совершенной
спайностью. Показатели преломления: Ng=1,574, Np=1,545, Ng — Np =
0,029. Оптический знак отрицательный. Удельный вес 2,23. Входит в состав
строительных растворов, различных вяжущих, силикатного кирпича, динаса.
Периклаз (окись магния) МgО встречается в виде округлых октаэдрических
или кубических кристаллов незначительных размеров. Спайность по плоскостям
куба. Чистый периклаз бесцветен, при частичном растворении в нем окислов
железа приобретает желтоватую окраску. Минерал изотропный, показатель
преломления N=1,734—1,737. В прозрачном шлифе распознается с трудом.
Определяется при травлении поверхности шлифа в силу своей большой отражающей
способности. Удельный вес 3,58. Периклаз — наиболее важная составная часть
магнезитовых и доломитовых огнеупоров, входит также в клинкер портландцемента,
в шлаки и т. д. Иногда в кристаллах периклаза, например в спекшемся
магнезите, наблюдаются темные точечные выделения магне-зиоферрита.
Кремнезем 5SiO2 в технических продуктах встречается в виде
различных полиморфных форм, из которых главными являются кварц, тридимит,
кристобалит, а также кремнеземистое стекло. Минерал кварц, представляющий собой
низкотемпературную форму SiO2 (образуется ниже 573°С).Остановимся на
характеристике других форм.
Тридимит — умеренная температурная форма SiO2. Кварц в
тридимит превращается при температуре выше 870° С. Кристаллы бесцветные или
светло-серые, имеют форму пластинок или удлиненных табличек, часто с
характерным образованием копьевидных двойников. Размер зерен может достигать
3—4 мм. Сингония ромбическая, удельный вес 2,27, Ng=1,473, Np =
1,469,. Ng-Np = 0,004.
В динасе содержание трндимита достигает 50—70%. Переход SiO2 в
тридимитовую форму сопровождается значительным увеличением объема. Встречается
также в шлаках.
Кристобалит — высокотемпературная фаза SiO2 (образуется при
температуре выше 1470°С). Дает правильные октаэдры, зернистые скопления и
чешуйчатые сростки, иногда с полисинтетическим двошшкованием сложной
сотовидной структуры (рис. 5). Кристаллы бесцветные, реже молочного цвета.
Удельный вес 2,32. Ng=1,487, Np=1,484, Ng — Np = 0,003. Входит в состав
динаса.
Кремнеземистое стекло возникает при достаточно быстром охлаждении
кремнеземистого расплава. Оно может быть бесцветным или молочной окраски,
последняя обусловлена воздушными пузырьками. Стекло изотропно. N= 1,459,
удельный вес 2,203. Устойчиво в кислотах (кроме плавиковой и фосфорной).
Кремнеземистое стекло широко применяется как изоляционный, кислотоупорный,
огнеупорный и электроизоляционный материал.
Гипс и продукты его обезвоживания
Гипс СаSО4∙Н2О и ангидрит СаSO4
— природные образования.Среди продуктов обезвоживания гипса выделяются
кристаллические вещества: α-полугидрат (СаSО4∙
0,5Н2О), β-полугидрат (СаSО4∙0,5Н2
О), γ-обезвоженный полугидрат, β-обезвоженный полугидрат, α-
ангидрит (СаSО4), β-ангидрит и γ-нерастворимый ангидрит.
α-Полугидрат СаSO4∙0,5Н2О получается при
нагревании гипса под давлением 120—125 атм. При этом образуются
бесцветные кристаллы в виде удлиненных игл или шестиугольных призм с
поперечными полосками (рис. 6). Сингония моноклинная. Показатели преломления
при обезвоживании возрастают: Ng=1,584, Np=1,559. Двупреломление высокое:
Ng — Np = 0,025.
Минерал может давать сростки и скопления (рис. 4). Примеси Fе2О3
и SiO2 вызывают появление плеохроизма в желтоватых и голубоватых
тонах. Удельный вес муллита 3,03. Размер кристаллов муллита разнообразен: от 2
до 5 мк в шамоте до 10 мм по длине в муллитовых изделиях.
Входит также в состав фарфора.
Силикаты кальция и магния
Окерманит 2СаО •МgО-2SiO2 встречается в природе и образуется
искусственно в виде бесцветных квадратных коротких призм или табличек с
показателями преломления: Ng=1,638, Nр=1,631. Двупреломление слабое:
Ng — Np = 0,007. Оптический знак положительный. Одноосный. Окерманит во всех
отношениях смешивается с геленитом, образуя серию геленитокерманитов
(мелилиты), оптические свойства которых варьируют вместе с составом. Форма
таких кристаллов сходна с геленитом. Их сингония тетрагональная. Удельный вес
3,18. Входят в состав магнезиальных цементов, огнеупоров, шлаков.
Монтичеллит СаО • МgО • 2SiO2 кристаллизуется в
ромбической системе и дает в природе и в технических продуктах бесцветные
призматические зерна со слабой неясной спайностью. Сингония ромбическая.
Удельный вес 3,2. Оптические свойства изучены недостаточно. Показатели
преломления при содержании его в виде 10%-ного твердого раствора
2MgO∙5SiO2 имеют следующие величины: Ng= 1,655—1,651,
Np=1,638—11,640, Ng—Nр = = 0,015, оптический знак положительный.
Встречается в различных шлаках.
Алюмоферрит кальция
Целит (алюмоферрит кальция) представляет собой кристаллы, состав которых
может варьировать от 8СаО • ЗА12О3 • Fе2О
3 до СаО • Fе2О3. Кристаллы целита в
портландцементном клинкере заполняют промежутки между алитом и белитом, иногда
создавая тончайшие прорастания с другими второстепенными минералами. Они имеют
призматическую или округлую форму, сингония ромбическая, цвет от светло-бурого
до темно-бурого. В шлифах ясно выражен плеохроизм от светло-желтых до
темно-бурых оттенков, угол погасания весьма мал. В отраженном свете целит
имеет большую отражательную способность, в силу чего кажется светлоокрашенным.
По данным Н. А. Торопова (1950), в клинкере с повышенным содержанием окиси
железа состав целита приближается к 2СаО ∙ Fе2О3 в
нормальных клинкерах — к 4СаО ∙ А12О3 ∙ Ре
2О3 и 8СаО ∙ ЗА12О3 ∙Ре2
О3.
Показатели преломления для 4СаО∙А12О3∙Fе2
О3 (разновидности, называемой браунмиллеритом): Ng =
2,08, Np=1,98, Ng — Np = 0,10. От содержания в нем 1—2% МgО (периклаза)
светопреломление несколько снижается, а клинкер приобретает характерную
зелено-серую окраску. Удельный вес 3,77. Присутствие браунмиллерита снижает
экзотермический эффект твердения портландцемента. Встречается также в шлаках.
Ферриты кальция
В эту группу входят два минерала: однокаль-циевый феррит СаО∙Fе2
О3 и двухкальциевый феррит 2СаО∙Fе2О3.
Оба они играют роль минерализаторов в различных огнеупорах и некоторых видах
портландцемента.
Однокальциевый феррит СаО∙Fе2О3 представляет
собой длинные игольчатые кристаллы, слабо прозрачные под микроскопом. Сингония
квадратная или гексагональная. Окраска черная, а в порошке интенсивно красная.
Показатели преломления: Ng = 2,465, Np = 2,345, двупре-ломление высокое: Ng
— Np = 0,120. Феррит в твердом состоянии может растворять в себе до 10%
СаО∙А12О3 и тогда показатели преломления снижаются:
Ng = 2,25, Np = 2,13, а двупреломление Ng — Np = 0,12. Растворяется
в кислотах. Встречается в составе клинкера глиноземистого цемента.
Двухкальциевый феррит 2СаО∙Fе2О3
кристаллизуется в виде черных кристаллов, которые в шлифах имеют
желтовато-бурую окраску. Спайность отсутствует Ng = 2,29,
Np = 2,20, Ng — Np = 0,090. Оптически положительный. Растворяется в соляной
кислоте.
Двухкальциевый феррит при гидратации твердения не дает. Образуется в
доломитовых огнеупорах, в портландцементе и шлаках. В магнезитовых
огнеупорных массах применяется как ускоритель спекания периклаза.
Окислы и гидроокислы
Известь СаО (свободная окись кальция) представляет собой бесцветные
кристаллы кубической сингонии. Форма зерен округлая. Встречаются кубики или
кучные скопления с ясно выраженной спайностью по трем взаимно перпендикулярным
направлениям. Кристаллы оптически изотропны. Их показатель преломления N=1,836.
В шлифах отличается грубым рельефом. СаО присутствует в клинкере
портландцемента (до 10%) обычно в виде мелких зернышек, которые иногда
наблюдаются внутри кристаллов ЗСаО∙А12О3, а также
в мартеновских шлаках и т. д. В отраженном свете СаО определяется методом
травления поверхности шлифов (микрохимические реакции).
Портландит (гидрат окиси кальция) Са(ОН)2. Образует
бесцветные шестиугольные кристаллы гексагональной сингонии с совершенной
спайностью. Показатели преломления: Ng=1,574, Np=1,545, Ng — Np =
0,029. Оптический знак отрицательный. Удельный вес 2,23. Входит в состав
строительных растворов, различных вяжущих, силикатного кирпича, динаса.
Периклаз (окись магния) МgО встречается в виде округлых октаэдрических
или кубических кристаллов незначительных размеров. Спайность по плоскостям
куба. Чистый периклаз бесцветен, при частичном растворении в нем окислов
железа приобретает желтоватую окраску. Минерал изотропный, показатель
преломления N=1,734—1,737. В прозрачном шлифе распознается с трудом.
Определяется при травлении поверхности шлифа в силу своей большой отражающей
способности. Удельный вес 3,58. Периклаз — наиболее важная составная часть
магнезитовых и доломитовых огнеупоров, входит также в клинкер портландцемента,
в шлаки и т. д. Иногда в кристаллах периклаза, например в спекшемся
магнезите, наблюдаются темные точечные выделения магне-зиоферрита.
Кремнезем 5SiO2 в технических продуктах встречается в виде
различных полиморфных форм, из которых главными являются кварц, тридимит,
кристобалит, а также кремнеземистое стекло. Минерал кварц, представляющий собой
низкотемпературную форму SiO2 (образуется ниже 573°С).Остановимся на
характеристике других форм.
Тридимит — умеренная температурная форма SiO2. Кварц в
тридимит превращается при температуре выше 870° С. Кристаллы бесцветные или
светло-серые, имеют форму пластинок или удлиненных табличек, часто с
характерным образованием копьевидных двойников. Размер зерен может достигать
3—4 мм. Сингония ромбическая, удельный вес 2,27, Ng=1,473, Np =
1,469,. Ng-Np = 0,004.
В динасе содержание трндимита достигает 50—70%. Переход SiO2 в
тридимитовую форму сопровождается значительным увеличением объема. Встречается
также в шлаках.
Кристобалит — высокотемпературная фаза SiO2 (образуется при
температуре выше 1470°С). Дает правильные октаэдры, зернистые скопления и
чешуйчатые сростки, иногда с полисинтетическим двошшкованием сложной
сотовидной структуры (рис. 5). Кристаллы бесцветные, реже молочного цвета.
Удельный вес 2,32. Ng=1,487, Np=1,484, Ng — Np = 0,003. Входит в состав
динаса.
Кремнеземистое стекло возникает при достаточно быстром охлаждении
кремнеземистого расплава. Оно может быть бесцветным или молочной окраски,
последняя обусловлена воздушными пузырьками. Стекло изотропно. N= 1,459,
удельный вес 2,203. Устойчиво в кислотах (кроме плавиковой и фосфорной).
Кремнеземистое стекло широко применяется как изоляционный, кислотоупорный,
огнеупорный и электроизоляционный материал.
Гипс и продукты его обезвоживания
Гипс СаSО4∙Н2О и ангидрит СаSO4
— природные образования.Среди продуктов обезвоживания гипса выделяются
кристаллические вещества: α-полугидрат (СаSО4∙
0,5Н2О), β-полугидрат (СаSО4∙0,5Н2
О), γ-обезвоженный полугидрат, β-обезвоженный полугидрат, α-
ангидрит (СаSО4), β-ангидрит и γ-нерастворимый ангидрит.
α-Полугидрат СаSO4∙0,5Н2О получается при
нагревании гипса под давлением 120—125 атм. При этом образуются
бесцветные кристаллы в виде удлиненных игл или шестиугольных призм с
поперечными полосками (рис. 6). Сингония моноклинная. Показатели преломления
при обезвоживании возрастают: Ng=1,584, Np=1,559. Двупреломление высокое:
Ng — Np = 0,025.
 Рис. 6. Продукт обжига α-полугидрата при 150° (150Х)
Удельный вес 2,72—2,73. Главная составная часть высокотемпературного гипса.
β-Полу гидрат СаSО4∙0,5Н2О образуется при
нагревании гипса на воздухе до 120° С и потере воды в виде газообразной
фазы. Дает мелкозернистую или волокнистую массу бесцветных кристаллов.
Ng=1,556, .Np = 1,550, Ng — Nр = 0,006. Удельный вес 2,67—2,68.
β-Полугидрат менее устойчив, чем α-полугидрат. Главная составная
часть варочного гипса.
Ангидрит СаSО4 — искусственный минерал, так называемый
растворимый ангидрит, образующийся при обезвоживании полугидратов при
температуре выше 220° С. Встречается в двух модификациях — αиβ.
Отличается по своим свойствам от природного растворимого ангидрита.
Растворимый ангидрит имеет форму призм с прямым погасанием и положительным
удлинением. Показатели преломления для α-ангидрита: Ng=1,570, Np=1,554,
для β-ангидрита: Ng=1,570, Nр = 1,546. Растворимые ангидриты на
воздухе быстро гидратируются.
Гипс и продукты его обезвоживания широко применяются в качестве вяжущего,
формовочного материала и т.д.
Прочие соединения кальция
Ольдгамит (сульфид) СаS образуется в составе основного доменного шлака в
присутствии значительного количества серы. Кристаллизуется в виде очень
мелких округлых изотропных зерен кубической сингонии с очень высоким
светопреломлением (N = 2,90). Зерна бесцветны, водянопрозрачны. Мелкие зерна
ольдгамита трудно различимы даже при больших увеличениях микроскопа. Удельный
вес 2,71. Входит в состав шлаков и цементов.
Перовскит СаО ∙ ТiO2 кристаллизуется в форме октаэдров
псевдокубической сингонии с ясно различимой спайностью. Окраска светло-бурая.
Показатель преломления N = 2,36. Входит в состав доменных шлаков.
Искусственные высокопрочные кристаллы
Высокопрочные искусственные кристаллы применяются в технике как режущий и
абразивный материал. Таких кристаллов уже известно более 40. Это различные
карбиды, нитриды, гидриды и бориды. Твердость их по шкале Мооса превышает 7.
Карбид бора — твердый раствор бора, В4С. Облик кристаллов
ромбоэдрический с усечением призматическими и пирамидальными формами. Сингония
гексагональная. Удельный вес 2,48—2,52. Твердость по шкале Мооса около 9. Под
микроскопом в отраженном свете карбид бора имеет белый цвет, высокую
отражательную способность, высокий рельеф.
Карбид кремния (карборунд) 51С кристаллизуется в зависимости от
температуры в кубическую (1650— 2000° С) или гексагональную (свыше 2000° С)
сингонии. Структуры карбида кремния относятся к слоистым и состоят из
чередующихся пачек слоев тетраэдров [814С] и [С514]
двоякой ориентации. Удельный вес кубического карбида кремния 3,216, а
гексагонального – 3,217, Ng=2.697, Np=2.654 , Ng-Np=0.043. В проходящем
свете – зеленый, синий, реже бесцветный или дымчатый. В отраженном свете
кристаллы светло-серые, почти белые, имеют высокую отражательную способность и
высокий рельеф. Твердость по шкале Мооса более 9.
Нитрид ниобия Nb3N5 образуется восстановлением
трехокиси ниобия сажей в атмосфере азота при 1200 ˚C. Это кристалл с
плотной гексагональной решеткой. Удельный вес 8,4. Твердость по шкале Мооса 8 –
9.
Карбиды вольфрама WC и W2C получают расплавлением
вольфрамового ангидрида WO3 c сажей в пламени вольтовой дуги. Оба
карбида относятся к гексагональной сингонии. Твердость по шкале Мооса у WC=9,
W2C =9 – 10.
Карбиды молибдена Мо2С и МоС получают расплавлением
смеси молибденового ангидрида с карбидом кальция и углем в вольтовой дуге или
плавлением шихты, содержащей уголь и МоО2. Кристаллы гексагональной
сингонии. Твердость по шкале Мооса 7 – 9.
Список используемой литературы:
1)Инжинерная геология. Минск 2001г.
2)Искуственые минералы, их свойства и строение. Москва1989г.
3)А так же по средствам Интернета, (рисунки).
Рис. 6. Продукт обжига α-полугидрата при 150° (150Х)
Удельный вес 2,72—2,73. Главная составная часть высокотемпературного гипса.
β-Полу гидрат СаSО4∙0,5Н2О образуется при
нагревании гипса на воздухе до 120° С и потере воды в виде газообразной
фазы. Дает мелкозернистую или волокнистую массу бесцветных кристаллов.
Ng=1,556, .Np = 1,550, Ng — Nр = 0,006. Удельный вес 2,67—2,68.
β-Полугидрат менее устойчив, чем α-полугидрат. Главная составная
часть варочного гипса.
Ангидрит СаSО4 — искусственный минерал, так называемый
растворимый ангидрит, образующийся при обезвоживании полугидратов при
температуре выше 220° С. Встречается в двух модификациях — αиβ.
Отличается по своим свойствам от природного растворимого ангидрита.
Растворимый ангидрит имеет форму призм с прямым погасанием и положительным
удлинением. Показатели преломления для α-ангидрита: Ng=1,570, Np=1,554,
для β-ангидрита: Ng=1,570, Nр = 1,546. Растворимые ангидриты на
воздухе быстро гидратируются.
Гипс и продукты его обезвоживания широко применяются в качестве вяжущего,
формовочного материала и т.д.
Прочие соединения кальция
Ольдгамит (сульфид) СаS образуется в составе основного доменного шлака в
присутствии значительного количества серы. Кристаллизуется в виде очень
мелких округлых изотропных зерен кубической сингонии с очень высоким
светопреломлением (N = 2,90). Зерна бесцветны, водянопрозрачны. Мелкие зерна
ольдгамита трудно различимы даже при больших увеличениях микроскопа. Удельный
вес 2,71. Входит в состав шлаков и цементов.
Перовскит СаО ∙ ТiO2 кристаллизуется в форме октаэдров
псевдокубической сингонии с ясно различимой спайностью. Окраска светло-бурая.
Показатель преломления N = 2,36. Входит в состав доменных шлаков.
Искусственные высокопрочные кристаллы
Высокопрочные искусственные кристаллы применяются в технике как режущий и
абразивный материал. Таких кристаллов уже известно более 40. Это различные
карбиды, нитриды, гидриды и бориды. Твердость их по шкале Мооса превышает 7.
Карбид бора — твердый раствор бора, В4С. Облик кристаллов
ромбоэдрический с усечением призматическими и пирамидальными формами. Сингония
гексагональная. Удельный вес 2,48—2,52. Твердость по шкале Мооса около 9. Под
микроскопом в отраженном свете карбид бора имеет белый цвет, высокую
отражательную способность, высокий рельеф.
Карбид кремния (карборунд) 51С кристаллизуется в зависимости от
температуры в кубическую (1650— 2000° С) или гексагональную (свыше 2000° С)
сингонии. Структуры карбида кремния относятся к слоистым и состоят из
чередующихся пачек слоев тетраэдров [814С] и [С514]
двоякой ориентации. Удельный вес кубического карбида кремния 3,216, а
гексагонального – 3,217, Ng=2.697, Np=2.654 , Ng-Np=0.043. В проходящем
свете – зеленый, синий, реже бесцветный или дымчатый. В отраженном свете
кристаллы светло-серые, почти белые, имеют высокую отражательную способность и
высокий рельеф. Твердость по шкале Мооса более 9.
Нитрид ниобия Nb3N5 образуется восстановлением
трехокиси ниобия сажей в атмосфере азота при 1200 ˚C. Это кристалл с
плотной гексагональной решеткой. Удельный вес 8,4. Твердость по шкале Мооса 8 –
9.
Карбиды вольфрама WC и W2C получают расплавлением
вольфрамового ангидрида WO3 c сажей в пламени вольтовой дуги. Оба
карбида относятся к гексагональной сингонии. Твердость по шкале Мооса у WC=9,
W2C =9 – 10.
Карбиды молибдена Мо2С и МоС получают расплавлением
смеси молибденового ангидрида с карбидом кальция и углем в вольтовой дуге или
плавлением шихты, содержащей уголь и МоО2. Кристаллы гексагональной
сингонии. Твердость по шкале Мооса 7 – 9.
Список используемой литературы:
1)Инжинерная геология. Минск 2001г.
2)Искуственые минералы, их свойства и строение. Москва1989г.
3)А так же по средствам Интернета, (рисунки).
|

