Контрольная: Концепции современного естествознания
эта работа была сделана на заказ!
список оригинальных работ( больше 100) в режиме off-line вы можете
посмотреть по адресу:
http://www.sinor.ru/~ranger/Ref
также вы найдете много учебной литературы и статей по всем предметам в моей
библиотеке on-line
http://www.sinor.ru/~ranger
Государственный комитет по высшему образованию Российской Федерации
Новосибирская государственная академия экономики и управления
Кафедра концепций современного естествознания
контрольная работа
по курсу: Концепции Современного Естествознания
Вариант 5
Выполнил ст. 1-го курса
заочного факультета
спец. Бухучет и Аудит
Новосибирск 1999
1. Использование законов сохранения импульса и момента импульса в
современной цивилизации
Законы сохранения импульса и момента импульса выполняются при любом
взаимодействии, об этом свидетельствуют многочисленные экспериментальные
данные. Таким образом, эти законы справедливы в мега-, макро- и микромире, и
называются великими законами сохранения.
В мега мире закон сохранения момента импульса объясняет наблюдаемую форму
галактик. Каждая галактика образовывалась из очень большой массы газа (порядка
1039—1040 кг), обладающей первоначальным моментом
импульса.
Широкое применение в современной технике имеет гироскоп. Гироскоп — это
осе симметричное тело, быстро вращающееся вокруг своей геометрической оси.
Простейшим примером этого прибора служит знакомая всем еще с детства игрушка
— волчок. Ось вращения сохраняет свое направления в пространстве неизменным,
если для удержания гироскопа использовать так называемый карданов подвес.
Такие устройства нашли широкое применение в авиации и космонавтике, в
устройствах, обеспечивающих ориентацию судов вблизи магнитного поля Земли.
При выборе огнестрельного оружия предпочтение отдается нарезному по
сравнению с гладкоствольным. Нарезное оружие, как известно, стреляет на
большие расстояния и с большей точностью. Проходя через ствол, пуля
закручивается и приобретает момент импульса, направленный вдоль скорости ее
движения. Этот момент импульса придает пуле устойчивую ориентацию в
пространстве, так, что различные турбулентности воздуха, возникающие в силу
быстрого ее движения, не могут отклонить ее от цели.
Из опытных данных хорошо известно, что элементарные частицы обладают
внутренним моментом импульса.
Экспериментальные методы исследования элементарных частиц основаны на законе
сохранения импульса. При столкновении элементарные частицы оставляют видимые
следы (треки) в специальных камерах, заполненных перенасыщенными парами воды
или перегретой жидкостью. При этом выводы о массе и свойствах элементарных
частиц делаются на основании закона сохранения импульса.
В игре "бильярд" сталкиваются шарики с равной массой. Как можно заметить из
опыта или заключить из закона сохранения импульса, при столкновении двух
шариков с равной массой, один из которых покоился, движущийся шарик при
столкновении передаст часть или весь свой импульс покоящемуся, а сам замедлит
или остановит свое движение. При столкновении шариков с существенно разными
массами направление и скорость движения изменит только легкий шарик. По этой
причине во многих видах спорта участников соревнований делят на группы с
примерно одинаковой массой участников в каждой из них.
Любое движение материальных тел осуществляется в строгом соответствии с
законом сохранения импульса. Поэтому освоение околоземного пространства и
полеты в космос невозможны без применения реактивной тяги. Закон сохранения
импульса ставит непростые вопросы перед "уфологами" периодически вступающими
в "контакт" с "инопланетным разумом".
2. поясните понятие инертной и гравитационной массы. Исходя из каких
фактов делается утверждение об их эквивалентности? Чтобы изменилось в
окружающем мире, если бы эти массы не были пропорциональны друг другу.
Галилей открыл явление падения всех тел на Земле с одинаковым ускорением. Масса
m связана с весом тела, но сам вес зависит от массы того тела, к которому
притягивается масса m. Следовательно, вес не может служить коэффициентом
пропорциональности между силой и ускорением, поэтому и вводят понятие инертной
массы M, которая характеризует "нежелание" тела сдвинуться с места. Масса не
зависит от направления движения (это многократно проверялось экспериментально)
и с точностью до 10-9является скалярной (лат. scataris
"ступенчатый") величиной.
Ньютон связал понятия массы и веса тела. Чтобы проверить выводы Галилея,
Ньютон провел серию опытов с маятниками и убедился, что свинцовый и
деревянный шары падают с одинаковыми ускорениями, значит, Земля в этом
случае одинаково действует на оба шара. Такое влияние Земли на каждый шар
(или каждое тело) можно выражать тяжестью, измеренной на весах путем
сравнения с тяжестью тела, принятой за единицу. Развивая мысль Галилея,
Ньютон вводит понятие силы F = MW как меру действия одного тела на другое,
отождествляя вес с силой действия, оказываемого на него Землей.
У Ньютона масса — единственная причина гравитационноного взаимодействия.
Массы входящие в уравнение закона всемирного тяготения, называют
гравитационными. В отличие от инертных масс которые служат коэффициентом
пропорциональности между силой, действующей на тело, и его ускорением,
гравитационные массы определяют силу гравитационного взаимодействия между
телами.Инертная масса была определена в динамическом опыте: прикладывается
известная сила, измеряется ускорение, и из формулы F = MW выводится масса М.
В законе гравитационного взаимодействия иная масса, она может определяться
из статического эксперимента: измеряют силу взаимодействия между двумя
телами, расположенными на определенном расстоянии.
Галилей пришел к выводу о пропорциональности гравитационной m и инертной М масс,
сбрасывая тела с высоты. Попробуем проследить за его рассуждениями. Допустим,
мы бросили вниз одновременно два тела, отличающиеся весом, — m1g и
m2g. Согласно второму закону Ньютона, их ускорения соответственно
будут определятся из соотношений: F1 = M1W1 и
F2 = M2W2. Сила, действующая на каждое тело,
равна его весу: m1g = M1W1 и m2g =
M2W2. Ускорение каждого тела при падении равно: W1
= (m1/M1)g и W2 == (m2/M2
)g. Эксперимент Галилея показал, что все тела при отсутствии сопротивления
падают с одинаковым ускорением, т. е. отношение ускорений равно единице, или
(W1/M2)= (m1/М1)(М2/m
2) = 1. Это возможно только при пропорциональности инертной и
гравитационной масс.
Последние эксперименты подтверждают равенство m = М с точностью до 10-11
. Опыты венгерского физика барона Лоранда фон Эт-веша показали универсальный
характер пропорциональности гравитационной и инертной масс, т. е. при
соответствующем выборе единиц измерения коэффициент пропорциональности можно
сделать равным единице. Универсальность означает пропорциональность масс для
всех веществ, поэтому они измеряются в граммах. Теория Ньютона не объясняет
причину этой пропорциональности.
Наглядным подтверждением совпадения инертной и гравитационной масс служит тот
факт, что все тела независимо от массы и состава падают на Землю с одним и
тем же ускорением свободного падения. Состояние невесомости - это состояние
свободного падения.
3. Поясните принцип Ле Шателье. Найдите примеры применения этого принципа
вне химии
Поскольку большинство химических реакций не идет до конца, то становится
важным понятие равновесия между прямой и обратной реакциями. В какой-то
момент их скорости сравняются, и в данной системе при данных условиях
установится динамическое равновеcue. Вывести систему из равновесия можно
только изменив условия согласно принципу, предложенному в 1884 г. Анри Луи
Ле: "Если в системе, находящейся в равновесии, изменить один из факторов
равновесия, например, увеличить давление, то произойдет реакция,
сопровождающаяся уменьшением объема, и наоборот. Если же такие реакции
происходят без изменения объема, то изменение давления не будет влиять на
равновесие".
Сейчас этот принцип формулируют так: внешнее воздействие, которое выводит
систему из состояния термодинамического равновесия, вызывает в ней процессы,
направленные на ослабление результатов такого влияния или, еще современнее,
что система выведенная внешним воздействием из состояния с минимальным
производством энтропии, стимулирует развитие процессов, направленных на
ослабление внешнего воздействия. Ле Шателье применял этот закон в
промышленных условиях для оптимизации синтеза аммиака, производства стекла и
цемента, выплавки металлов, получения взрывчатых веществ. Катализаторы, как
оказалось, не влияют на положение равновесия: они одинаково влияют на прямую
и обратную реакции, ускоряют достижение равновесия, но не сдвигают его.
Примером применения этого принципа вне химии может быть следующая ситуация:
Массовое размножение грызунов влечет за собой увеличение численности хищников
и паразитов. Они сокращают численность популяции грызунов. Но вслед за этим
сокращается численность хищников, так как они начинают погибать от голода. Т.
е. Равновесие в экосистеме восстанавливается.
4. Поясните понятие «фазы» и «фазового перехода». Какие фазовые переходы
относят к фазовым переходам первого и второго родов, что лежит в основе такой
классификации. Приведите примеры.
фазами называют различные однородные части физико-химических систем.
Однородным является вещество, когда все параметры состояния вещества
одинаковы во всех его элементарных объемах, размеры которых велики по
сравнению с межатомными состояниями. Смеси различных газов всегда составляют
одну фазу, если во всем объеме они находятся в одинаковых концентрациях. Одно
и то же вещество в зависимости от внешних условий может быть в одном из трех
агрегатных состояний — жидком, твердом или газообразном. В зависимости от
внешних условий система может находиться в равновесии либо в одной фазе,
либо сразу в нескольких фазах.
Во время фазового перехода температура не меняется, но меняется объем
системы. Фазовые переходы бывают нескольких родов. Существуют такие условия
давления и температуры, при которых вещество находится в равновесии в разных
фазах. Температуры, при которых происходят переходы из одной фазы в другую,
называются температурами перехода. Они зависят от давления, хотя и в
различной степени: температура плавления — слабее, температуры
парообразования и сублимации — сильнее.
Изменения агрегатных состояний вещества называются фазовыми переходами 1-го
рода, если: 1) температура постоянна во время всего перехода; 2) меняется
объем системы; 3) меняется энтропия системы.
Чтобы произошел такой фазовый переход, нужно данной массе вещества сообщить
определенное количество тепла, соответствующего скрытой теплоте превращения.
В самом деле, при переходе из более конденсированной фазы в фазу с меньшей
плотностью нужно сообщить некоторое количество энергии в форме теплоты,
которое пойдет на разрушение кристаллической решетки (при плавлении) или на
удаление молекул жидкости друг от. друга (при парообразовании). Во время
преобразования скрытая теплота пойдет на преодоление сил сцепления,
интенсивность теплового движения не изменится, в результате температура
остается постоянной. При таком переходе степень беспорядка, следовательно, и
энтропия, возрастает. Если процесс идет в обратном направления, то скрытая
теплота выделяется.
Фазовые переходы 2-го, 3-го и т.д. родов связаны с порядком тех производных
термодинамического потенциала дФ, которые испытывают конечные изменения в
точке перехода.
Такая классификация фазовых превращений связана с работами физика-теоретика
Пауля Эренфеста. Так, в случае фазового перехода 2-го рода в точке перехода
испытывают скачки производные второго порядка: теплоемкость при постоянном
давлении с = -Т(д2Ф/дТ2), сжимаемость b=-(1/V0
)( д2Ф/дp2), коэффициент теплового расширения a= (1/V
0)( д2Ф/дTp), тогда как первые производные остаются
непрерывными. Это означает отсутствие выделения (поглощения) тепла и изменения
удельного объема (Ф — термодинамический потенциал).
В 1937 г. Ландау показал, что фазовые переходы 2-го рода связаны с
изменением симметрии системы: выше точки перехода система, как правило,
обладает более высокой симметрией. Например, в магнетике спиновые моменты
выше точки ориентированы хаотически, и одновременное вращение всех спинов
вокруг одной оси на одинаковый угол не изменяет свойств системы. Ниже точки
перехода спины имеют некоторую преимущественную ориентацию, и одновременный
их поворот меняет направление магнитного момента системы. Ландау ввел
коэффициент упорядочения и разложил термодинамический потенциал в точке
перехода по степеням этого коэффициента, на основе чего построил
классификацию всех возможных типов переходов, а также теорию явлений
сверхтекучести и сверхпроводимости.
В окружающей нас природе мы особенно часто наблюдаем фазовые переходы воды.
При переходе воды в пар происходит сначала испарение — переход поверхностного
слоя жидкости в пар, при этом в пар переходят только самые быстрые молекулы:
они должны преодолеть притяжение окружающих молекул, поэтому уменьшаются их
средняя кинетическая энергия и, соответственно, температура жидкости.
Наблюдается в быту и обратный процесс — конденсация.
Оба эти процесса зависят от внешних условий. В некоторых случаях между ними
устанавливается динамическое равновесие, когда число молекул, покидающих
жидкость, становится равным числу молекул, возвращающихся в нее. Опыт
показывает, что насыщенный пар, или пар, находящийся в динамическом
равновесии со своей жидкостью, не подчиняется закону Бойля — Мариотта,
поскольку его давление не зависит от объема. Процессы испарения и
конденсации воды обуславливают сложные взаимодействия атмосферы и гидросферы,
имеют важное значение в формировании погоды и климата. Между атмосферой и
гидросферой происходит непрерывный обмен веществом (круговорот воды) и
энергией.
Исследования показали, что с поверхности Мирового океана, составляющего 94 %
земной гидросферы, за сутки испаряется около 7 000 км3 воды и
примерно столько же выпадает в виде осадков. Водяной пар, увлекаемый
конвекционным движением воздуха, поднимается вверх и попадает в холодные слои
тропосферы. По мере подъема пар становится все более насыщенным, затем
конденсируется, образуя дождевые и облачные капли. В процессе конденсации пара
в тропосфере за сутки выделяется около 1,6-1022 Дж теплоты, что в
десятки тысяч раз превосходит вырабатываемую человечеством энергию за то же
время.
Если процесс перехода жидкости в пар происходит во всем объеме, то его
называют кипением. Разрыв пузырьков у поверхности кипящей жидкости
свидетельствует, что давление пара в них превышает давление над поверхностью
жидкости.
Поздней осенью, когда после сырой погоды наступает резкое похолодание, на
ветвях деревьев и на проводах можно наблюдать иней — это десублимировавшие
кристаллики льда. Подобное явление используют при хранении мороженого, когда
углекислота охлаждается, так как переходящие в пар молекулы уносят энергию.
На Марсе явления сублимации и десублимации углекислоты в его полярных шапках
играют такую же роль, что и испарение — конденсация в атмосфере и гидросфере
Земли.
5. в чем уникальность строения атома углерода и почему он так
распространен в соединениях. Почему нашу жизнь иногда называют углеродной.
С точки зрения химии жизнь — это всевозможные превращения разнообразных
крупных и сложных молекул, главным элементом которых является углерод. Он
важен не с точки зрения распространенности на Земле, в земной коре углерода
всего 0,055 %, в то время как кислорода 60,50 %, кремния 20,45 % и даже
титана 0,27 %. В атмосфере двуокиси углерода 0,03 %, т. е. углерода всего
0,008 %. Все биологически функциональные вещества, кроме нескольких солей и
воды, содержат углерод. Это белки, жиры, углеводы, гормоны, витамины. Число
соединений углерода огромно. Они называются органическими соединениями,
поскольку когда-то считалось, что такие молекулы могут образовываться только
в живых организмах.
Органическая химия посвящена изучению углерода и его соединений. Атомный номер
углерода — 6, его ядро содержит шесть протонов и шесть нейтронов, вокруг ядра
вращаются шесть электронов, масса атома С равна 12. При химических реакциях
углерод способен присоединить 4 электрона и образовать устойчивую оболочку из
восьми электронов, т. е. имеет валентность, равную четырем, и способен к
прочной ковалентной (присоединением электронов) связи. Например, эмпирическая
формула одного из таких прочных соединений — метана — СН4, а в
структурном изображении — это тетраэдр (четыре симметричные связи углерода).
Уникальным свойством углерода является его способность образовывать
стабильные цепи и кольца, которые обеспечивают разнообразие органических
соединений, причем эти связи могут быть кратными. При этом важно
расположение атомов в пространстве, которое приводит к оптической активности
вещества, к отличию в повороте плоскости поляризации проходящего света (рис.
1). Структурные формулы наглядно отражают связь формулы со свойствами
вещества, с их помощью стало возможным объяснение изомерии и предсказание
свойств неизвестных еще соединений.
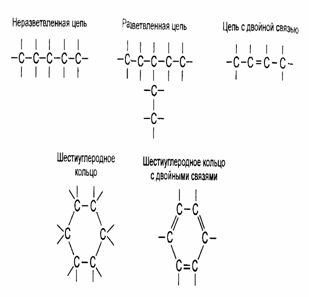
Рис. 1. Способы соединения атомов углерода друг с другом Черточки со
свободными концами при каждом атоме углерода показывают, что он может
образовывать связи с атомами других элементов (обычно это водород, кислород,
азот, сера)
Зная валентность углерода, можно достаточно просто изобразить положение всех
недостающих водородных атомов, что позволяет сосредоточить внимание на
наиболее важных связях и химических группах. Такие прочные ковалентные связи
углерод может образовывать и с атомами других элементов (Н, О, Р, N, S), и с
углеродными (С-С связь). Внутреннее отличие органики от большинства
неорганических соединений выражается в том, что химические связи, как
правило, в органических соединениях валентные, а ионные связи — очень редки.
Поэтому углерод обладает этими уникальными свойствами, среди которых еще не
отмечена способность соединений углерода к полимеризации и поликонденсации, а
наша жизнь называется углеродной.
6. Преобразования энергии и круговорот веществ в природе. Чем они
отличаются и что между ними общего.
Биосфера представляет из себя единство живого и минеральных элементов,
вовлеченных в сферу жизни. Она распределена по земной поверхности крайне
неравномерно и в различных природных условиях принимает вид относительно
независимых комплексов — биогеоценозов (или экосистем). Живая часть
биогеоценоза — биоценоз - состоит из популяций организмов разных видов.
Одним из самых больших достижений науки в XX в. является выяснение механизмов
превращения энергии в биологических системах Сейчас уже понятно, как солнечная
энергия преобразуется в специальных пигментных структурах растений в энергию
химических связей, как превращаются вещества в процессах брожения и гликолиза
(окисление углеводов без кислорода), как происходит внутриклеточное дыхание —
перенос электронов в митохондриях от коферментов к кислороду. В центре этих
превращений в клетке находится АТФ, которая синтезируется из АДФ и Н3
РО4 за счет световой энергии или энергии, выделяемой при гликолизе,
брожении или дыхании. При гликолизе АТФ выделяется энергия, необходимая для
совершения всей работы живого организма — от создания градиентов концентрации
ионов и сокращения мышц до синтеза белка.
Биосфера улавливает лишь небольшую часть солнечной энергии, поступающей на
Землю. Ультрафиолетовая часть солнечного излучения, которая составляет 30 %
всей солнечной энергии, доходящей до Земли, практически полностью
задерживается атмосферой. Половина поступающей энергии превращается в тепло и
затем излучается в космическое пространство, 20% расходуется на испарение
воды и образование облаков и только около 0,02 % используется биосферой.
Зеленые растения усваивают эту энергию, поглощая молекул».) хлорофилла, и
процессе фотосинтеза преобразуют ее и запасают и форме сахарен. От этого
процесса зависит нее существование биосферы.
Животные, поедая растения, а хищники — травоядных животных, освобождают для
себя эту энергию, сжигая сахара и другие питательные вещества при помощи
кислорода. Переработка пищи в организмах сопровождается выделением энергии,
при этом часть ее запасается в форме химической энергии и используется для
совершения работы. В отличие от простейших существ, у которых сжигание
веществ может происходить в любой части организма, высшие животные обладают
специальной системой, распределяющей по организму кислород и энергоносители.
В легких кровь поглощает кислород и выделяет углекислый газ, в кишечнике она
получает питательные вещества. Процессы переваривания пищи обеспечивают
разложение сложных компонентов пищи на более простые, которые усваиваются
кишечником и поступают в кровь, при этом высвобождается энергия. Конечные
продукты обмена веществ (избыток солей, воды, чужеродные и токсичные
соединения) поступают через почки в мочу и выводятся из организма.
Животные не получают необходимую им энергию непосредственно от Солнца. Для
добывания пищи им нужна сенсорная система ее обнаружения (глаза, уши, нос или
сонар — ультразвуковой локатор, иные органы) и мускульная система,
приводящая в движение их органы (руки, ноги, плавники, крылья и т.д.). Кроме
того, у растений и животных имеются регулирующие системы — железы, выделяющие
гормоны, и нервная система. В организме постоянно совершается работа:
перекачивается кровь, поглощаются питательные вещества, происходят процессы
возбуждения молекул, в которых запасается энергия, выводятся отходы
жизнедеятельности и вредные вещества и т. д. Для создания упорядоченных
систем (высокого уровня генетической или нервной организации) тоже
необходима энергия. Эффективное функционирование всех систем обеспечивается
также информацией о внешнем и внутреннем окружении. Работа состоит в
выработке сигналов, которые регулируют энергетические процессы, организуют
биоструктуры, контролируют расход энергии на разные раздражители и т. п.
Удовлетворение энергетических потребностей организмов происходит в рамках
равновесия, которое устанавливается между различными организмами данной
среды обитания (экосистемы). Среди обитателей обычно выделяют два типа
организмов: одни способны непосредственно использовать солнечную энергию и
перерабатывать
в пищу вещества из неживой окружающей среды (автотрофы), другие зависят от
остальных производителей энергии, т. е. сами не производят необходимую им
пищу {гетеротрофы). Все элементы, из которых построены организмы,
многократно используются в биосфере, тем более, что масса всего живого,
когда-либо заселявшего Землю, много больше массы самой Земли. Обмен энергии
в биосфере отличается от круговорота веществ в ней. Частично энергия
рассеивается при переходе от продуцентов (зеленых растений) к травоядным, а
затем и к плотоядным животным (редуцентам), поэтому необходима постоянная
подпитка биосферы солнечной энергией.
Основу биосферы составляет биотический круговорот органических веществ при
участии всех населяющих ее организмов. В закономерностях этого круговорота
решена проблема развития и длительного существования жизни. Мы не говорим
"бесконечного", потому что все на земле имеет конец: сама Земля представляет
собой ограниченное тело, конечен запас минеральных элементов и т. д.
"Единственный способ придать ограниченному количеству свойство
бесконечного, — писал академик В. Р. Вильяме, — это заставить его вращаться
по замкнутой кривой. Зеленые растения создают органическое вещество,
незеленые разрушают его. Из минеральных соединений, полученных из распада
органического вещества, новые зеленые растения строят новое органическое
вещество и так без конца".
Жизнь на Земле идет именно таким путем. Каждый вид — это только звено в
биотическом круговороте. Непрерывность жизни обеспечивается процессами
синтеза и распада, каждый организм отдает или выделяет то, что используют
другие организмы. Особенно велика в этом круговороте роль микроорганизмов,
которые превращают остатки животных и растений в минеральные соли и
простейшие органические соединения, вновь используемые зелеными растениями
для синтеза новых органических веществ. При разрушении сложных органических
соединений высвобождается энергия, теряется информация, свойственная сложно
организованным существам. Любая форма жизни участвует в биотическом
круговороте, и на нем основана саморегуляция биосферы. Микроорганизмы при
этом играют двоякую роль: они быстро приспосабливаются к разным условиям
жизни и могут использовать различные субстраты в качестве источника углерода
и энергии. Высшие организмы не обладают такими способностями и потому
располагаются выше одноклеточных в экологической пирамиде, опираясь на них,
как на фундамент.
Биотический круговорот состоит из разных круговоротов, причем каждый биоценоз
представляет модель биосферы в миниатюре. Важны и исторические факторы
формирования биоценоза, и климат, и ландшафт, и многое другое. Например,
экосистема леса включает биоценозы различных типов лесов — хвойные,
лиственные, тропические, каждый из которых характеризуется своим
круговоротом веществ. В этом мне кажется проявляется отличие биотического
круговорота от круговорота энергии, второе отличие: по закону сохранения
энергии энергия не возникает ниоткуда и не уходит в никуда, т.е.
преобразование энергии вечно (именно в данном круговороте энергии), а
круговорот веществ в природе имеет свое окончание, как уже было сказано выше.
7. Какие виды взаимодействий Вы знаете и какие из них играют важную роль
в повседневной жизни и почему.
В настоящее время известны четыре типа взаимодействий: гравитационные, слабые,
электромагнитные и сильные. Физике XVII—XVIII вв. были известны только
гравитационные взаимодействия. Было найдено, что гравитационные силы прямо
пропорциональны произведению масс и обратно пропорциональны квадрату
расстояния между массами. Мы постоянно ощущаем гравитацию в нашей жизни.
Гравитация (лат gravifas "тяжесть"), или тяготение, не очень существенна при
взаимодействии между малыми частицами, но она удерживает планеты, всю Солнечную
систему и галактики. По закону всемирного тяготения (открытого Ньютоном),
описывающему это взаимодействие в хорошем приближении, две точечные массы
притягивают друг друга с силой, направленной вдоль соединяющей их прямой: F
гр= - Gm1*m2/r2
Знак минус указывает, что мы имеем дело с притяжением, r — расстояние между
телами (считается, что размер тел много меньше г), m1 и m2
— массы тел. Величина G — универсальная постоянная, определяющая величину
гравитационных сил. Если тела массами в 1 кг находятся на расстоянии 1 м друг
от друга, то сила притяжения между ними равна 6,67-1011 Н. Если бы
величина G была больше, то увеличилась бы и сила. Утверждение об
универсальности постоянной G означает, что в любом месте Вселенной и в любой
момент времени сила притяжения между массами в 1 кг, разделенными расстоянием
в 1 м, будет иметь то же значение. Поэтому можно говорить об универсальности
постоянной G и о том, что она определяет структуру гравитирующих систем.
Обратимся теперь к электромагнитному взаимодействию. И электрические, и
магнитные силы обусловлены электрическими зарядами. Силы взаимодействия
между зарядами сложным образом зависят от положения и движения зарядов. Если
два заряда e1 и е2, неподвижны и сосредоточены в точках на расстоянии г, то
взаимодействие между ними чисто электрическое и определяется простой
зависимостью (закон Кулона):
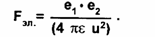
Здесь сила электрического взаимодействия, направленная вдоль прямой, соединяющей
заряды, будет силой притяжения или отталкивания в зависимости от знаков
зарядов е1 и е2 Через e обозначена универсальная
постоянная, определяющая интенсивность электростатического взаимодействия, ее
значение 8,85 • 1012 Ф/м. Электрический заряд всегда связан с
элементарными частицами. Численная величина заряда наиболее известных среди них
— протона и электрона — одинакова: это универсальная постоянная, равная 1,6 *10
-19 Кл. Заряд протона считается положительным (обозначается е),
электрона — отрицательным.
Магнитные силы полностью порождаются электрическими токами — движением
электрических зарядов. Существуют попытки объединения теорий с учетом
симметрий, в которых предсказывается существование магнитных зарядов, но они
пока не обнаружены. Поэтому величина е определяет и интенсивность магнитного
взаимодействия.
Если электрические заряды движутся с ускорением, то они отдают энергию в
виде света, радиоволн или рентгеновских лучей. Видимый свет является
электромагнитным излучением определенного диапазона частот. Почти все
носители информации, воспринимаемые нашими органами чувств, имеют
электромагнитную природу, хотя и проявляются подчас в сложных формах.
'Электромагнитные взаимодействия определяют структуру и поведение атомов,
удерживают атомы от распада, отвечают за связи между молекулами, т.е. за
химические и биологические явления. Гравитация и электромагнетизм —
дальнодействующие силы, распространяющиеся на всю Вселенную.
Сильные и слабые ядерные взаимодействия — короткодействующие и проявляются
только в пределах размеров атомного ядра.
Слабое взаимодействие ответственно за многие ядерные процессы, например,
такие, как превращение нейтронов в протоны, и сильнее других сказывается на
превращениях частиц. Поэтому эффективность слабого взаимодействия можно
охарактеризовать универсальной постоянной связи g(W), определяющей скорость
протекании процессов типа распада нейтрона. Через ядерное слабое
взаимодействие одни субатомные частицы могут превращаться в другие.
Сильное ядерное взаимодействие имеет более сложную природу. Именно оно
препятствует распаду атомных ядер, и не будь его, ядра распались бы из-за сил
электрического отталкивания протонов. С этим типом взаимодействия связаны
энергия, выделяемая Солнцем и звездами, превращения в ядерных реакторах и
освобождение энергии. В ряде простейших случаев для его характеристики можно
ввести величину g(S), аналогичную электрическому заряду, но много большую.
Здесь есть некоторые особенности — сильное взаимодействие не удовлетворяет
закону обратной пропорциональности, как гравитационное или электромагнитное:
оно очень резко спадает за пределами эффективной области радиусом около 10
-15м. Кроме того, внутри протонов и нейтронов также существует сильное
взаимодействие между теми элементарными частицами, из которых они состоят,
следовательно, взаимодействие протонов и нейтронов есть отражение их внутренних
взаимодействий. Но пока картина этих глубинных явлений скрыта от нас.
Перечисленные типы взаимодействий имеют, видимо, разную природу. К настоящему
времени неясно, исчерпываются ли ими все взаимодействия в природе. Самым
сильным является короткодействующее сильное взаимодействие, электромагнитное
слабее его на два порядка, слабое — на 14 порядков, а гравитационнное — самое
слабое, оно меньше сильного на 39 порядков. В соответствии с величиной сил
взаимодействия они происходят за разное время. Сильные ядерные взаимодействия
происходят при столкновении частиц с околосветовыми скоростями, и время
реакций, определяемое делением радиуса действия сил на скорость света, дает
величину порядка 10-23 с. В случае слабого взаимодействия процессы
происходят медленней — за 10-9 с. Характерные времена для
гравитационного взаимодействия порядка 1016 с, или 300 млн лет.
Среди электромагнитных взаимодействий для примера можно выделить химическую
реакцию, в медицине - рентгеновское обследование. Что касается любви – то
это соединение всех четырех взаимодействий в одно.
8. В чем суть соотношения неопределенностей Гейзенберга? Как Вы понимаете
слова Ричарда Феймана: «Микрочастицы не похожи ни на что, из того, что Вам хоть
когда-нибудь приходилось видеть».
Гейзенберг представил физические величины как совокупность всех возможных
амплитуд перехода из одного квантового состояния в другие. Сама вероятность
перехода пропорциональна квадрату модуля амплитуды, именно эти амплитуды и
наблюдаются в экспериментах. Тогда каждая величина должна иметь два индекса,
соответствующих верхнему и нижнему состояниям. Эти величины называются
матрицами. Гейзенберг получил и уравнения для наблюдаемых величин, но в
первоначальном виде они были сложными. В 1926 г. он сумел объяснить отличие
двух систем термов для пара- и ортогелия как соответствующих симметричным и
антисимметричным решениям его уравнения.
Гейзенберг в решении проблем, которыми начал заниматься с 1925 г., шел от
наглядных феноменологических моделей. В 1927 г. он при поддержке Бора и его
школы предложил устранить противоречие волна — частица, которое он понимал
как некую аналогию. Считая, что "совокупность атомных явлений невозможно
непосредственно выразить нашим языком", он предложил отказаться от
представления о материальной точке, точно локализованной во времени и
пространстве. Либо точное положение в пространстве при полной
неопределенности во времени, либо наоборот — таково требование квантовых
скачков.
Так Гейзенберг пришел к формулировке принципа неопределенности,
устанавливающего границы применимости классической физики. Этот принцип,
принесший ему большую известность и до сих пор вызывающий дискуссии,
представляет фундаментальное положение квантовой теории, отражая ограничение
информации о микробъектах самими средствами наблюдения. Гейзенберг подсчитал
Предельную точность определения положения и скорости электрона из так
называемых перестановочных соотношений квантовой механики. В то время в
моде были мысленные эксперименты. Допустим, в какой-то момент нам нужно
угнать положение и скорость электрона. Самый точный метод — осветить электрон
пучком фотонов. Электрон столкнется с фотоном, и его положение будет
определено с точностью до длины волны используемого фотона. Для максимальной
точности нужно использовать фотоны наименьшей длины, т. е. большей частоты,
или обладающие большими энергией Е и импульсом hv/c. Но чем больше импульс
фотона, тем сильнее он исказит импульс электрона. Чтобы знать точно
положение электрона, нужно использовать фотоны бесконечной частоты, но тогда
и импульс его будет бесконечным, так что количество движения электрона будет
совершенно неопределенным. И, наоборот, желая определить точно импульс
электрона, из аналогичных рассуждений придем к неопределенности и положении.
Выразив неопределенность положения как Dq, а неопределенность импульса как
р, получим Dq Dр³h. Если взять сопряженные им величины — энергию Е и
время t, то квантово-механическое соотношение неопределенности для них будет
Dt DЕ³h.
Высказывание Ричарда Феймана лишь доказывает что, сложно представить
частицу, которая бы обладала свойствами и волны, и частицы.
9. как происходит образование элементов во Вселенной по модели Большого
взрыва. Поясните распространенность химических элементов в солнечной системе.
Светимость нашей Галактики оценивают числом 1054 эрг/с. Если возраст
Галактики 1010 лет, то при постоянной светимости она выделила за
-это время 2*1061 эрг. При образовании одного ядра гелия выделяется
энергия 2,5* 10-5 эрг. Следовательно, за время существования
Галактики в ней образовалось 1066 альфа-частиц. При массе частицы
6,67*10-24 г это составляет 7*1042 г, а масса Галактики —
4*1044 г. Поэтому к нашему времени отношение гелия к водороду Не/Н
могло бы быть 7/400, или 1/57, по массе или 1/230 по числу атомов. Это меньше
наблюдаемого соотношения в 20 раз, так как из анализа состава звездных
атмосфер, космических лучей получается Не/Н порядка 1/11. Уже из таких простых
оценок понятно, как получать согласие модели с данными соотношениями.
Плотность материи во Вселенной r практически совпадает с плотностью реликтового
излучения. Она может быть выражена через энергию r = Е/с2, а,
значит, и температуру Е = sТ4. С другой стороны, r = M/(4/3)pR
3, R = (9GMt2/2)1/3 и r (5*105/t2
) г/см3. Здесь время t в секундах. Отсюда ясна связь температуры Т и
времени, прошедшего от начала расширения: Т@ 1010/Öt
Сначала (при t<0,01 с) температура очень высока, и вещество состоит из
нейтронов и протонов в равных пропорциях. Благодаря присутствию электронов,
позитронов, нейтрино и антинейтрино происходит непрерывное превращение n + е
+« р + u- и обратно, р + е- «n+ u. При охлаждении
за первые 10 с число протонов увеличится за счет нейтронов, и начнется
образование дейтерия, трития, изотопа гелия He-3 и Не-4. Через 100 с от начала
расширения заканчиваются все ядерные превращения: водорода получается 0,9,
гелия — 0,09, остальное приходится на более тяжелые элементы. По весу водород
составляет около 0,7, гелий — 0,3. Это и есть химический состав Вселенной к
началу формирования звезд и галактик.
Для наглядности эту начальную стадию делят на четыре "эры". Для каждой из них
можно выделить преобладающую форму существования материи, в соответствии с
чем и даны названия.
В самом начале эры адронов, продолжавшейся 0,0001 с, была велика энергия
гамма-квантов. При высоких температурах могли существовать частицы только
больших масс, для которых существенно и гравитационное взаимодействие.
Элементарные частицы разделяют на адроны и лептоны, причем первые могут
участвовать в сильных и быстрых взаимодействиях, а вторые — в более слабых и
медленных, поэтому первые эры получили такие названия.
Адронная эра — эра тяжелых частиц и мезонов. Плотность d > 1014, Т
> 1012 К, t< 0,0001 с. Основную роль играет излучение,
количества вещества и антивещества могут быть примерно равными. В конце
адронной эры происходит аннигиляция частиц и античастиц, но остается некоторое
количество протонов. Из равновесия с излучением
вышли последовательно гипероны, нуклоны, К- и p-мезоны и их античастицы.
Продолжительность эры лептонов 0,0001 <t< 10с, при этом 1010 К
< Т <1012 К; 104 < d < 1014
Основную роль, играют легкие частицы, принимающие участие в реакциях между
протонами и нейтронами. Постепенно из равновесия с излучением вышли мю-мезоны
и их античастицы, электронные и мезонные нейтрино, а избыточные мюоны распались
на электроны, электронное антинейтрино и мю-онное нейтрино. В конце эры
лептонов происходит аннигиляция электронов и позитронов. Спустя 0,2 с
Вселенная становится прозрачной для электронных нейтрино, и они перестают
взаимодействовать с веществом. Согласно теории, эти реликтовые нейтрино
сохранились до нашего времени, но температура их должна была снизиться до 2 К,
поэтому пока их не могут обнаружить.
Далее приходит фотонная эра продолжительностью 1 млн лет. Основная доля
массы—энергии Вселенной приходится на фотоны, которые еще взаимодействуют с
веществом. В первые 5 мин эры происходили события, во многом определившие
устройство нашего мира. В конце лептонной эры происходили взаимные
превращения протонов и нейтронов друг в друга. К началу эры фотонов
количества их были примерно равными. При уменьшении температуры протонов
стало больше, поскольку реакции с образованием протонов оказывались
энергетически более выгодными и, значит, более вероятными. Это определило
скорости реакций, и к началу эры число нейтронов остановилось на 15%.
В начале эры излучения 3000 К < T< 1010 К; 10-21
< d < 104г/см3 нейтроны захватываются протонами, и
происходит образование ядер гелия. Кроме того, за эти первые минуты некоторое
количество нейтронов пошло на образование ядер бериллия и лития, а некоторое
количество распалось. В результате доля гелия в веществе могла составить 1/3.
В конце эры температура снизилась до 3 000 К, плотность уменьшилась на 5-6
порядков, в результате чего создались условия для образования первичных атомов.
Излучение отделилось от вещества, Вселенная стала прозрачной для вещества, и
пришла новая эра — эра вещества. Излучение играет главную роль, образуется
гелий. В конце эры главную роль в образовании вещества Вселенной начинает
трать вещество.
В звездную эру, наступившую при t порядка 1 млн. лет, Т приблизительно равно 3
000 К, а плотность d порядка 10-21г/см3 Начинается
сложный процесс образования протозвезд и протогалактик.
Основными источниками сведений о распространенности химических элементов
служат данные о составе Солнца полученные с помощью спектрального анализа, и
результаты лабораторных химических анализов материала земной коры.
метеоритов пород поверхности Луны и планет.. Принято выражать количество
атомов какого-либо химического элемента по отношению к кремнию в разных
природных системах. поскольку кремний принадлежит к обильным и труднолетучим
элeментам.
С ростом порядкового номера распространенность элементов убывает
неравномерно, причем элементы с четным порядковым номе' ром более
распространены, чем с нечетным, особенно элементы с массовым числом, кратным
4, например. Не, С, О, Ne, Мд, Si, S, Ar, Са. ряд максимумов соответствует
элементам с ядрами, у которых число протонов или нейтронов равно 2. 8. 20,
50, 82, 126 . Этим "магическим" числам соответствуют заполненные ядерные
оболочки, характеризующие устойчивые ядра. По этому поводу американские
космохимики Гарольд Юри и Г.Зюсс сказали так: "Представляется, что
распространенность элементов и их изотопов определяется ядерными свойствами и
что окружающее нас вещество похоже на юлу космическою ядерною пожара, в
котором оно было создано".
Большинство газов (или летучей части солнечного вещества) — Н, Не, СО, О, N,
СО2 и все инертные газы. Основную часть внутренних планет и метеоритов
составляют нелетучие элементы солнечного вещества — Si, Ре, Vg, Са, Al, Mi,
Na. Проводя детальные сравнения, Виноградов показал, что эти породообразующие
элементы планет и метеоритов непосредственно выброшены Солнцем, и не
захвачены из других областей Галактики. Некоторые различия в составе планет
связаны с вторичными процессами и тем, что элементы входят в разные
соединения, пребывая в разных агрегатных состояниях. Особенно близок состав
нелетучей части элементов Солнца и наиболее распространенных каменных
метеоритов — хондритов.
Летучая часть солнечного вещества, существующая в виде газов при Т>0, при
низких температурах переходит в твердое состояние, а атомы газов вступают в
соединения. Инертные газы в соединения не вступают, оставаясь и при низких
температурах в газообразном состоянии. Земля и метеориты сохранили летучие
элементы в той степени, и какой они проявляли свою активность, поэтому
инертные газы как на Земле, так и в метеоритах встречаются редко. Что касается
изотопного состава С, О, Si, Cl, Fe, Ni, Со, Ва, К, Си, то он одинаков на
Земле и в метеоритах. Относительно Солнца таких широких исследований не
проведено, но для С12:С13 он такой же, как и на Земле. Исследования по инертным
газам показали идентичность изотопного состава в солнечной системе, но на
других звездах это отношение иное.
Таким образом, все тела солнечной системы построены из небольшого числа
элементов (около 28 номера таблицы Менделеева распространенность существенно
падает) и имеют единое происхождение. Метеориты, большинство которых
оказались очень древними, дали ценную научную информацию об истории
возникновения отдельных тел солнечной системы. По оценкам, основанным на
радиоактивном распаде урана, тория, рубидия и калия, их возраст около
4,5—4,6 млрд лет, т. е. совпадает с возрастом Земли и Луны. В них
насчитываются примерно 66 минералов, большинство из них похожи на земные.
Вероятно, метеориты образовались тогда же, что и планеты земной группы.
Согласно принятой в геологии классификации, все элементы разделены на четыре
группы. Атмофильные элементы склонны накапливаться в атмосферах; литофильные
образуют твердые оболочки планет; халькофильные создают соединения с серой,
подобные меди; сидерофильные способны растворяться в сплавах железа.
10. Круговороты каких веществ определяют основные факторы
формирования климата и каким образом.
Планеты земной группы, как предполагают ученые, когда-то были похожи друг на
друга.
Разница в климате возникла из-зи разного круговорота углекислого газа при
обмене им между корой и атмосферой. Как и водяной пар, углекислый газ
является газом парниковым, так как он, пропуская солнечный свет, поглощает
тепло планеты и переизлучает часть его к поверхности.
Оценки сделанные М. Хартром, показали снижение содержания углекислого газа в
атмосфере со скоростью, точно компенсирующей возрастание светимости Солнца.
Он провел аналогичные рассчеты для иных, чем у Земли, расстояний от Солнца и
получил, что при расстоянии от Солнца меньше 1 а. Е. На 5% атмосфера бы
нагрелась настолько, что океаны испарились бы в результате разгоняющегося
парникового эффекта, а на расстоянии дальше на 1% а. Е. От Солнца имело бы
разгоняющееся оледенение. Только в узкой полоске расстояний между 0,95 и 1,01
а.е. Земля смогла бы избежать этой катастрофы климата.
Нелепо предполагать, что это редкая случайность – появление жизни на нашей
планете в таком узком кольце Солнечной системы. Скорее всего, содержание
углекислого газа менялось в соответствии с изменением температуры поверхности
Земли. Этот режим саморегуляции обеспечил нашей планете устойчивость климата.
Эта обратная связь могла обеспечиваться карбонатно-силикатным геохимическим
циклом, который способен отвечать за 80% обмена углекислым газом между
планетой и ее атмосферой на временных интервалах более 0,5 млн. лет.
Началом цикла можно считать растворение содержащегося в атмосфере углекислого
газа в водяных капельках и образование угольной кислоты. Дождевые осадки
разрушали горные породы, состоявшие из соединений кальция, кремния и кислорода.
Угольная кислота вступает в реакцию с породами на поверхности, высвобождая ионы
кальция и бикарбоната, которые поступают в грунтовые воды, а затем в океан,
где оседают в скелетах и раковинах планктона и других организмах, состоящих из
карбоната кальция (СаСО3). Останки этих организмов откладываются на
океанском дне, формируя осадочные породы. Дно моря расширяется, через много
тысяч лет эти породы приблизятся к краям континентов. Дно подтягивает их под
берег, они попадают в земные, недра, где на них действуют давление и
температура. Карбонат кальция соединяется с кремнием, образуя силикатные породы
и выделяя углекислый газ, т. е. происходит карбонатный метаболизм. Газ попадает
вновь в атмосферу через извержения вулканов и срединно-океанические хребты.
Цикл завершается (рис. 129).
Изменения температуры земной поверхности влияют на количество углекислого газа
в атмосфере и величину парникового эффекта. Пусть по какой-то причине на Земле
стало прохладнее. При более низкой температуре меньше воды испарится из океана
в атмосферу, меньше выпадет дождей, и уменьшится эрозия почвы, вызванная
осадками. Тогда скорость покидания атмосферы углекислым газом уменьшится, а
скорость регенерации его в процессе карбонатного метаболизма и поступления в
атмосферу останется на прежнем уровне. Это приведет к накоплению СО2
, усилению парникового эффекта и восстановлению более теплого климата. Если по
какой-то причине на Земле произошло потепление, то обратная связь сработает в
другую сторону, и равновесие установится. Предположим, что все океаны
вымерзли, дожди прекратились,
содержание СО, в атмосфере возросло. При современной скорости выделения
давление его в 1 бар создается за 20 млн. лет, такого количества углекислого
газа хватит на поднятие средней температуры до +50 °С. Значит, льды растают и
восстановится нормальный для жизни климат.
В круговороте углекислого газа большую роль играют живые организмы,
определяющие изменения климата. Часть углекислого газа (около 20 %), не
участвующая в карбонатно-силикатном обмене, выводится из атмосферы
фотосинтезирующими растениями. При гниении растений и окислении в почве
накапливается СО2, в результате его оказывается в почве больше, чем
было 400 млн. лет назад до появления растений, поэтому превращение силикатных
материалов в осадочные карбонатные породы происходит быстрее. Расчеты
показывают, что исчезновение растений привело бы в повышению температуры на
10° за счет отрицательной обратной связи силикатно-карбонатного цикла.
|

